Annexin V-FITC/PI双染检测细胞凋亡
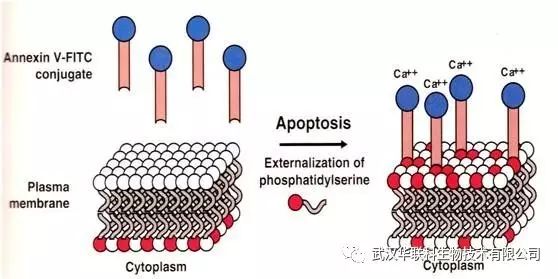
正常细胞膜磷脂的分布是不对称的,膜内表面含负电的磷脂(如磷脂酰丝氨酸,PS),而膜外表面含有占绝大多数的中性磷脂。在细胞凋亡的早期,细胞膜内的PS会从内侧翻转到细胞膜表面。
Annexin V是一种钙依赖性磷脂结合蛋白,能与PS高亲和力特异性结合。
PI是一种核酸染料,它不能透过完整的细胞膜,而早期凋亡细胞的细胞膜是完好的,对PI有拒染性。但在凋亡中晚期的细胞和死细胞,PI能透过细胞膜而使细胞核染上。
因此Annexin V 和PI同时使用,可以将凋亡早期的细胞与其它细胞区别开来。
实验步骤
细胞凋亡(Annexin V-FITC/PI染色)适用于:细胞未转染GFP或未使用红色药物。
1.收集细胞:包括漂浮在培养基上的细胞;之后,须把EDTA洗去,PBS或培养基重悬送样,正常组细胞分出200μl体积不染色;
2.离心:1000转/分,5分钟,弃上清;
3.重悬:加入200μl Binding Buffer,混匀;
4.染色:加入5μl Annexin V-FITC,室温避光孵育10分钟;
5.离心:1000转/分,5分钟,弃上清;
6.重悬:加入200μl Binding Buffer,混匀;
7.染色:加入5μl PI,直接上机。
注意事项
1.包括漂浮在培养基上的细胞,一起收集;
2.洗细胞后,建议轻轻摇匀细胞沉淀,避免使用加液枪,以免由于塑料枪头的使用造成细胞损失;
3.一次检测很多样本,加入PI应该有一定的时间间隔(一般以30~60s为宜),因为PI本身有毒。
对照组凋亡比例高的原因
1.细胞状态不好;
2.细胞收集后存放的时间太长,没有及时染色;
3.细胞表面原有的PS相对较多,应选用低浓度的AnnexinV标记;
4.PBMC表面往往有血小板黏附在细胞表面,造成Annexin V阳性率偏高;
5.过分吹打、震荡或胰酶消化等,可能使PS暴露出来。
处理组凋亡比例低的原因
1.凋亡刺激得不够;
2.细胞本身生长状态可能对刺激因素不敏感,如过度增殖的细胞对凋亡的诱导不太敏感;
3.Annexin V的结合缓冲液失效,应4 ℃保存;
4.贴壁细胞消化时间过长,膜表面的PS受损,Annexin V结合位点减少。


