动物模型构建
短肠综合症指的是在小肠广泛切除或旷置后,肠道有效吸收面积显著减少,残存的功能性肠管不能维持患者的营养,以至于出现以腹泻、酸碱、水、电解质紊乱以及各种营养物质吸收和代谢障碍为主要临床症状的症候群。SBS是成人慢性肠衰竭的最常见的病因,由于部分患者的剩余肠道不能满足机体代谢和营养的需求,不得不长期依赖肠外营养的补充,但长期使用肠外营养以及其相关并发症又会给SBS患者带来很大影响。因此,构建短肠综合症大鼠模型有助于深入研究该疾病的发病机制、评估治疗方案以及探索新的治疗方法。
通常选择体重在200~300克的雄性大鼠,如Wistar大鼠或Sprague-Dawley大鼠。这些大鼠的消化系统结构与人类相似,且术后恢复较快,适合用于研究肠道适应机制和治疗策略。
大鼠在代谢笼中饲养3~5天以适应环境。术前1天给予半流食,术前12小时禁食,但允许少量饮水。术前使用适量的戊巴比妥钠或异氟醚进行全身麻醉。
在大鼠腹部行纵向正中切口,逐层打开腹腔,切除大约75%的小肠。空肠近端保留约10厘米,回肠末端也保留约10厘米。切除后,将空回肠断端以丝线间断缝合,确保吻合口无张力且通畅。
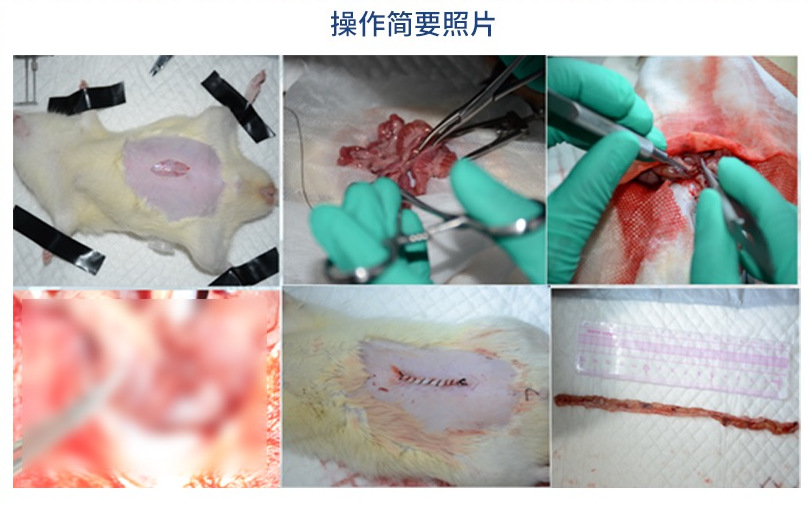

术后通常禁食24小时,避免对肠道产生机械性应激。禁食期间通过腹腔注射或皮下注射补充营养液和生理盐水。术后可通过皮下注射抗生素(如青霉素)以预防术后感染。
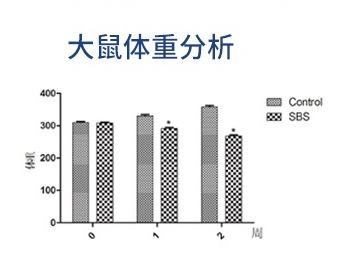
定期监测大鼠的体重和摄食量,评估术后肠道功能变化。术后体重变化是评估SBS模型成功的重要指标。
通过收集和称量粪便,评估粪便量及水分含量,判断肠道吸收功能是否受损。短肠综合症常伴有腹泻,因此粪便量和含水量增加是常见现象。
检测血清中的电解质、总蛋白、白蛋白及肝功能指标,评估肠道吸收障碍对全身营养和代谢的影响。
如测定血浆D-木糖水平以评估小肠吸收能力。
通过HE染色观察术后肠道黏膜的增厚、绒毛长度及肠腺结构变化,评估肠道再生和适应情况。
通过16S rRNA基因测序或实时定量PCR分析肠道菌群变化,评估短肠综合症对肠道微生态的影响。





