一文搞定|从0-1,教你如何做双荧光素酶实验?

双荧光素酶报告基因系统是一种用于研究基因表达调控、蛋白质相互作用和信号通路的常用技术。
该技术诞生于1990年,距今已有30多年的发展史,1993年第一个萤光素酶专利获批,1996年双萤光素酶报告基因检测系统推出,之后广泛用于生物医疗领域。
该系统通常使用两种不同的荧光素酶。
目前,以北美萤火虫(Photinus pyralis)来源的荧光素酶基因和提取自海洋腔肠动物海肾(Renilla reniformis)的荧光素酶应用的最为广泛。
前者可编码550个氨基酸的荧光素酶蛋白,是一个62kDa的单体酶,无需表达后修饰,直接具有可被检测的酶活(张菊梅等, 2001)。
后者也是一种可以催化荧光素发生荧光反应的单亚基特异活性蛋白,其分子量为36kDa;同萤火虫荧光素酶一样,该蛋白质在完成转录翻译后即具有催化活性(赵斯斯, 2012)。
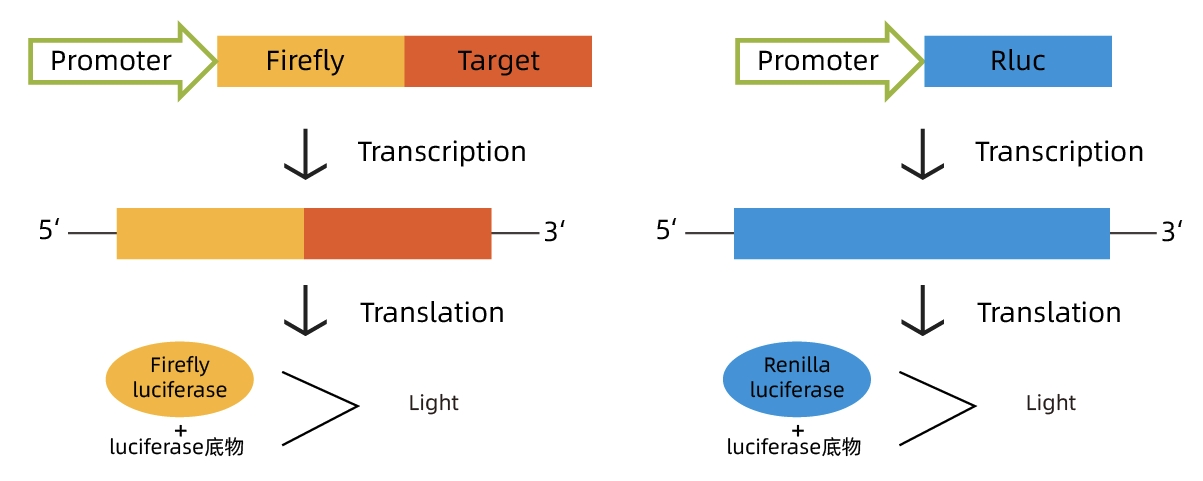
利用荧光素酶与底物结合发生化学发光反应的特性,将感兴趣的基因的转录调控元件克隆在萤火虫荧光素酶基因的上/下游,构建成荧光素酶报告质粒。
然后转染细胞,经适当刺激或处理后裂解细胞,测定荧光素酶活性。通过荧光素酶活性的高低(具体表现为荧光值高低)判断刺激前后或不同刺激对感兴趣的调控元件的影响。
Renilla luciferase的报告基因质粒作为内参,排除不同组之间细胞生长状况、细胞数目以及转染效率带来的干扰,起到校正的作用,从而使实验结果更为可靠。
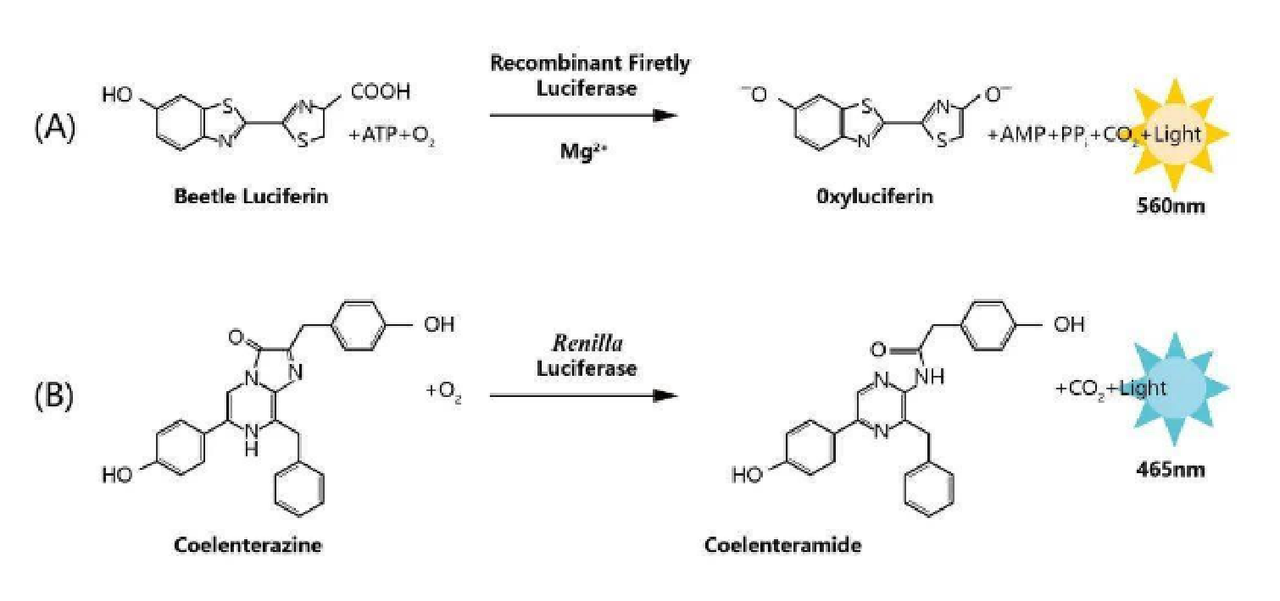
萤火虫荧光素酶:在ATP、Mg²+及O₂的共同参与下,催化荧光素氧化,并发出黄绿色的光芒,发光波长主要在540~600nm。
海肾荧光素酶:在O₂参与下,催化腔肠素氧化,发出蓝色的光芒,发光波长主要在460~540nm。
目前,常用的F-Luc(萤火虫荧光素酶)载体大多以pMIR-REPORT载体、pGL3系列载体为主;R-Luc(海肾荧光素酶)载体大多以pRL系列载体为主;

-
报告基因质粒构建:将目的片段插入到荧光素酶表达的报告基因载体上。
-
转染细胞:将报告基因质粒和内参质粒共转染细胞(48h)。
-
细胞处理:根据实验需要对细胞进行处理。
-
裂解细胞:加入裂解液裂解细胞。
-
测定荧光值:加入底物荧光素,测定萤火虫荧光素酶和海肾荧光素酶的荧光值。
-
数据处理:计算相对荧光素酶活性,并进行统计分析(如t检验或ANOVA)以评估组间差异的显著性。
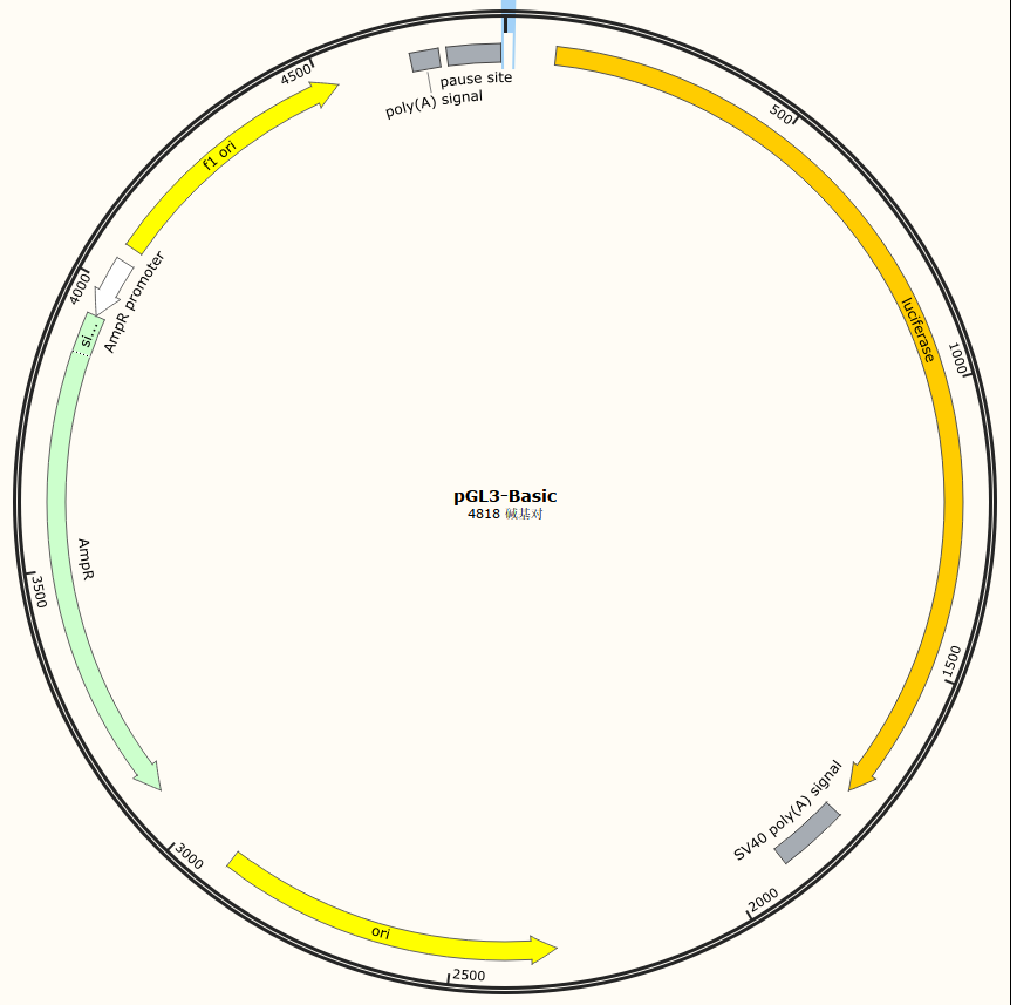
插入到荧光基因上游:启动子序列
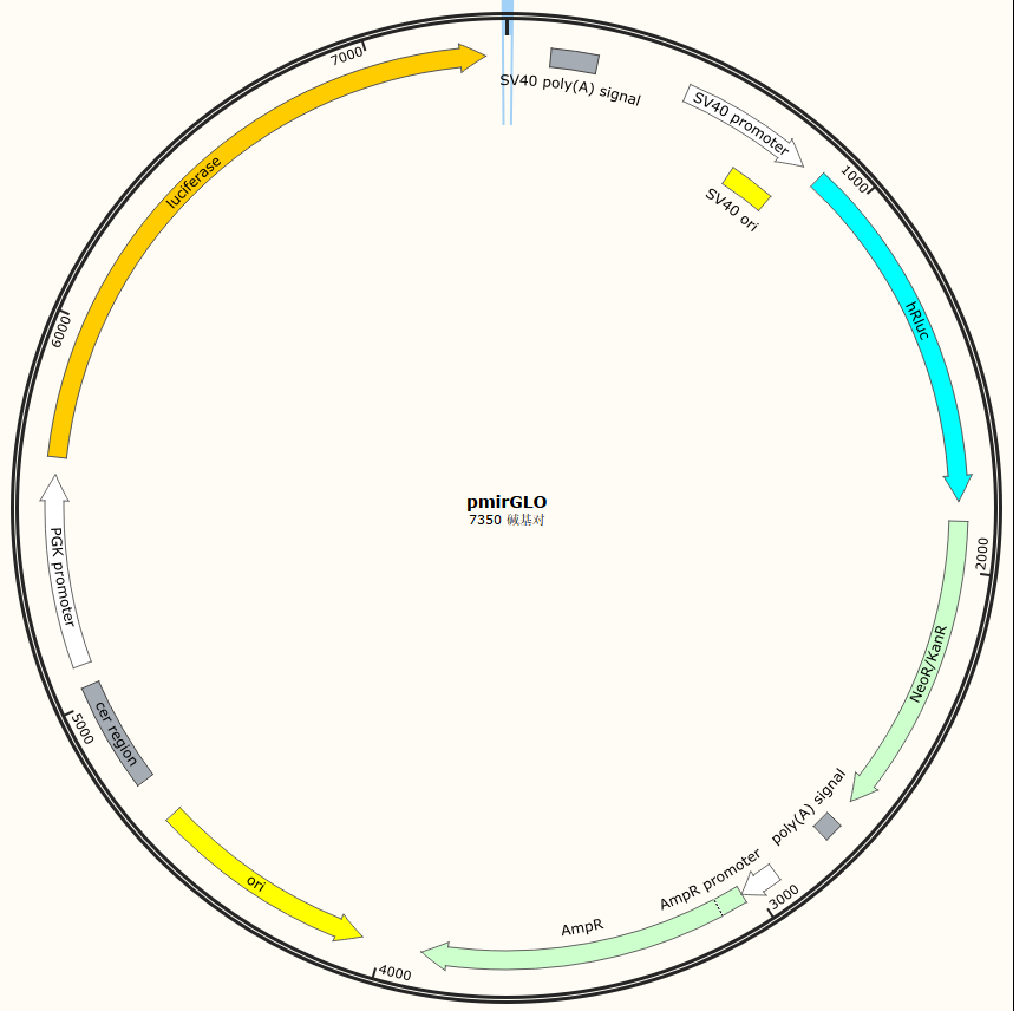
插入到荧光基因下游:3’UTR序列
-
miRNA与靶基因的靶向互作研究:验证miRNA与mRNA、lncRNA、cirRNA互作;CeRNA机制研究;
-
转录因子与启动子互作:研究转录因子对基因表达的调控作用;
-
启动子活性分析:验证启动子的表达模式及强度;
-
启动子SNP分析:一些基因的启动子区域存在单核苷酸多态性,可运用荧光素酶报告系统分析其相对活性;
-
研究细胞内信号通路的激活和传导:将特定信号通路的下游响应元件克隆到报告基因载体中,通过测量不同上游条件下荧光素酶活性的变化来评估该信号通路的反应情况;
-
药物筛选:用于高通量药物筛选,评估药物对基因表达的影响;
华联科拥有成熟的双荧光素酶报告基因系统和实验平台,为您提供量身定制一整套相关技术服务。
服务特点
-
稳定性强:荧光素酶一旦翻译产生即具有报告活性,且不易降解;
-
特异性强:细胞内无内源性荧光素酶表达,避免了其他因素的干扰;
-
无交叉干扰:两种荧光素酶反应底物互不干扰,确保了实验结果的准确性;
-
灵敏度高,比 Western blot 灵敏度高 1000 倍以上;
-
应用范围广泛;
-
检测方便、周期较短;
服务流程
序列评估、靶点预测→基因合成及载体构建→质粒提取→细胞转染→双荧光素酶检测→数据分析
客户提供
基因:提供详细的转录因子、目的基因、或 microRNA 信息;
细胞:无特殊需求,默认使用 293T 细胞,则无需提供;
交付内容
-
项目结题报告;
-
原始数据(图片、分析结果等);



